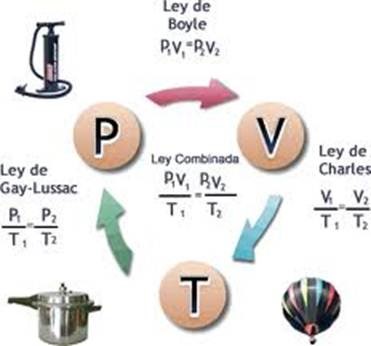
Ley de Boyle: Presión y Volumen.
Una sencilla ley de los gases, descubierta por
Robert Boyle en 1662, describe la relación entre la presión y el volumen de un
gas. La ley de Boyle establece que para
una cantidad determinada de gas a temperatura constante, el volumen del gas
varia inversamente con la presión. Es decir, cuando la presión aumenta, el
volumen disminuye; cuando la presión disminuye, el volumen aumenta.Piensa en los gases como los representa la teoría cinético-molecular. Un gas ejerce una presión específica porque las moléculas de gas rebotan contra las paredes del recipiente con cierta frecuencia. Si el volumen del recipiente se expande sin que cambie la cantidad de gas, el número de moléculas por unidad de volumen de gas disminuye. En consecuencia, también disminuye la frecuencia con la que las moléculas inciden en una unidad de área de las paredes del recipiente y la presión del gas se reduce. Así pues, a medida de que el volumen de un gas aumenta, su presión disminuye.
Para una cantidad específica de gas a temperatura
constante, la expresión matemática de la Ley de Boyle es:
V=
a/p o PV=a
Donde
a es una constante de proporcionalidad.
Otra forma de enunciar la ley de Boyle
es, por tanto, que para una cantidad específica de gas a temperatura constante,
el producto de la presión por el volumen es constante.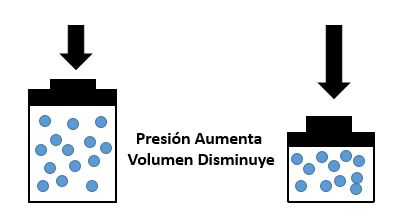

Ley de Charles: temperatura y volumen.
En 1787 el físico francés Jacques
Charles, pionero en el uso de globos de aire caliente, estudio la relación
entre el volumen y la temperatura de los gases.
Charles encontró que cuando una masa fija
de gas se enfría a una presión constante, su volumen disminuye. Cuando el gas
se calienta, su volumen aumenta. La temperatura y el volumen varían de manera
directa; es decir, aumentan o disminuyen conjuntamente. Pero esta ley requiere
un poco mas de reflexión. Si una cantidad determinada de gas que ocupa 1.00 L
se calienta de 100ºC a 200ºC a presión constante, el volumen no se duplica, si
no que aumenta solo hasta alrededor de 1.27 L. La relación entre la temperatura
y el volumen no es tan simple como podría parecer a simple vista.
Cuando se habla de presión cero o de
volumen cero realmente quiere decir cero, esto es, no se puede medir presión o
volumen alguno. Cero grados Celsius (0ºC) significa solo el punto de
congelación del agua, este punto cero se ha fijado de manera arbitraria, así
como el nivel promedio del mar es el cero arbitrario para las mediciones de
altitud de la Tierra. Con frecuencia se observan temperaturas inferiores a 0ºC,
como también hay altitudes bajo el nivel del mar.
Charles advirtió que por cada grado
Celsius de aumento en la temperatura, el volumen de un gas se incrementa 1/273
su volumen a 0ºC. si hacemos una grafica del volumen, en función de la
temperatura obtendremos una línea recta.
Una forma moderna de enunciar la ley de
Charles es, por tanto, que el volumen de
una cantidad fija de un gas en un recipiente a una presión constante, es
directamente proporcional a su temperatura.
V=
bT o V/T=b
b
es una constante de proporcionalidad.


Ley de Gay-Lussac: Presión y Volumen.
Esta Ley fue enunciada
por Joseph Louis Gay-Lussac a principios de 1800. Establece que la presión de
un volumen fijo de gas, es directamente proporcional a su temperatura. Esto se
debe que al aumentar la temperatura, las moléculas del gas se mueven más
rápidamente y por tanto aumenta el número de choques contra las paredes, es
decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen
no puede cambiar.
Gay-Lussac descubrió que en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
P/T=K
Para entender mejor
sigamos el siguiente ejemplo: Supongamos que tenemos un gas a una presión inicial
(P1) y a una temperatura inicial (T1). Si aumentamos la
temperatura (T2) entonces la presión se incrementara (P2)
por lo tanto se cumple:
P1/T1=P2/T2

 referencias: https://books.google.com.mx/books?id=RPz95Q6ZJaIC&pg=PA22&dq=fisica+teoria+cinetica+de+la+materia&hl=es&sa=X&redir_esc=y#v=onepage&q=fisica%20teoria%20cinetica%20de%20la%20materia&f=false
referencias: https://books.google.com.mx/books?id=RPz95Q6ZJaIC&pg=PA22&dq=fisica+teoria+cinetica+de+la+materia&hl=es&sa=X&redir_esc=y#v=onepage&q=fisica%20teoria%20cinetica%20de%20la%20materia&f=false


No hay comentarios:
Publicar un comentario